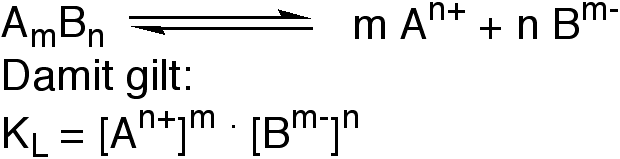Zum Inhaltsverzeichnis
4. Löslichkeitsberechnungen in Wasser
Als neues stoffchemisches Beispiel dient die Fällung von Bariumsulfat:
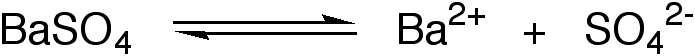
a) In reinem Wasser ist die Löslichkeit (L) gleich der Menge von in Lösung befindlichem BaSO4, das natürlich dissoziiert vorliegt, also
Löslichkeit = [Ba2+] = [SO42-]
Zusammenhang zwischen L und KL:
KL = [Ba2+][SO42-] = [Ba2+]2 = L2
L = KL0.5
im vorliegenden Beispiel: KL = 1.5.10-9 mol2/l2 und L = 3.9.10-5 mol/l
Verallgemeinerte Fällungsgleichung: die stöchiometrischen Koeffizienten gehen im hier vorliegenden Spezialfall der Fällungsreaktionen genauso ein wie im (allgemeineren) Massenwirkungsgesetz.
Die Verbindung AmBn liefert in Lösung die Ionen An+ und Bm-
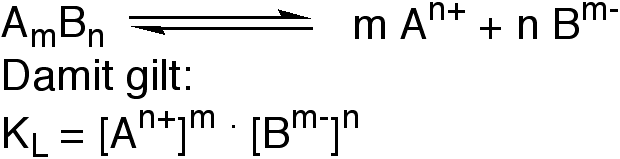
Wie gross ist L, also die Konzentration an gelöstem Stoff?
Vollständige Dissoziation wird vorausgesetzt; dann kann man ansetzen, dass aus jeder Formeleinheit AmBn, die sich in Lösung befindet, m Kationen und n Anionen entstehen:

und aufgeloest nach L:
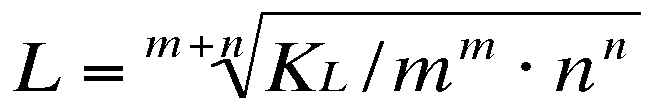
An dieser Gleichung sieht man, dass die Dimension von KL Substanz-abhängig sein muss, denn L hat die Dimension einer Konzentration.
Übung: wie lautet L als Funktion von KL fuer Al2O3? | Antwort |
b) Statt in reinem Wasser soll die Löslichkeit (L) unter Zusatz von Barium- oder Sulfat-Ionen, untersucht werden; man spricht von sogenanntem gleichionigem Zusatz.
Beispiel: wie gross ist die Löslichkeit von Bariumsulfat in 0.1 m Natriumsulfat-Lösung?
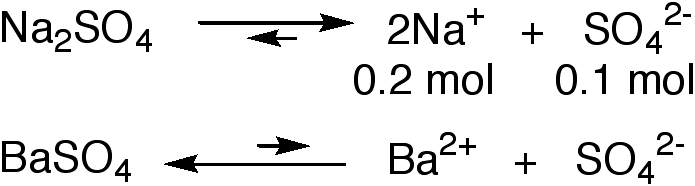
Es gibt also zwei Quellen fuer Sulfat-Ionen; die massgebliche besteht in der Dissoziation von Natriumsulfat, da die Eigendissoziation von Bariumsulfat gering ist.
Man kann daher
[SO42-] zu 0.1 mol/l
annaehern und in KL einsetzen
KL = [Ba2+][SO42-] = [Ba2+]0.1 mol/l = 1.5.10-9 mol2/l2
Wieviel Bariumsulfat dissoziiert unter diesen Bedingungen - nach [Ba2+] Aufloesen ergibt
L = 1.5.10-9 mol2/l2 / 0.1 mol/l = 1.5.10-8 mol/l
Vergleich mit L in Wasser - L = 3.9.10-5 mol/l - zeigt:
Die Löslichkeit eines Salzes wird durch gleichionigen Zusatz herabgesetzt.
c) Was passiert bei Zugabe von Ionen, die nicht im Löslichkeitsprodukt vorkommen, sogenanntem fremdionigem Zusatz?
Auf dem Niveau des Löslichkeitsprodukts bleibt ein derartiger Zusatz ohne Einfluss. Eine genauere Betrachtung zeigt, dass Konzentrationen im Massenwirkungsgesetz eine Näherung sind; strenggenommen müsste man Aktivitäten einsetzen.
Aktivitäten sind kleiner als Konzentrationen, sie nehmen mit zunehmendem Gehalt der Lösung an Ionen jedweder Art, der sogenannten Ionenstärke, ab. Fremdioniger Zusatz erhöht daher die Löslichkeit.
...weiter
Zum Inhaltsverzeichnis
Autor: Prof. U. Englert, IAC
(24.01.2012, 26.07.2004, 11.10.2004)
|