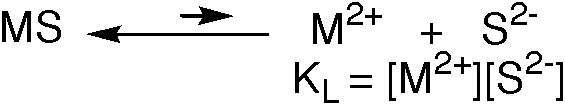
Wie gross ist die Konzentration an Sulfid-Dianionen? Sie hängt vom pH-Wert ab! Qualitative Betrachtung - in Worten: Je saurer die Lösung, desto geringer ist die Dissoziation der schwachen Säure H2S.
Quantitative Betrachtung ueber das Dissozationsgleichgewicht:
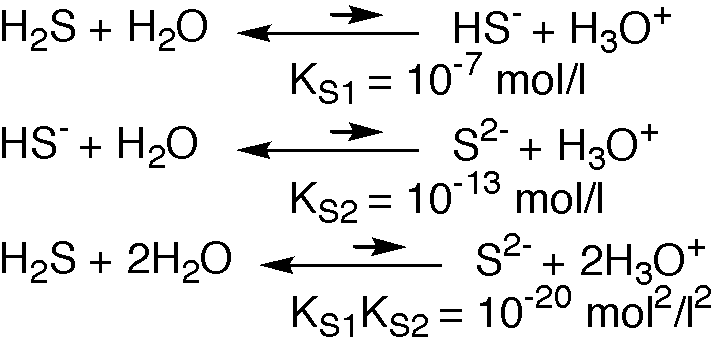
damit gilt:
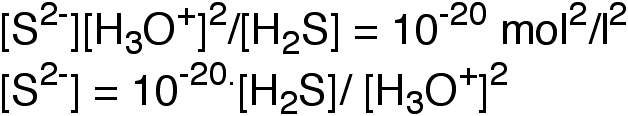
eine gesättigte Lösung von H2S ist ca. 0.1 molar, damit
Beispiele für die Sulfid-Ionen-Konzentrationen bei bestimmten pH-Werten:
pH = 0, [H3O+]2 = 1, [S2-] = 10-21
pH = 7, [H3O+]2 = 10-14, [S2-] = 10-7
Typische Löslichkeitsprodukte für die Sulfide liegen bei 10-15 - 10-59,
z.B. PbS: KL = 10-29, FeS: KL = 10-20
Im stark Saurem, z. B. bei pH = 0, fällt kein FeS, denn die Fe-Konzentration müsste 10 molar sein, um das Löslichkeitsprodukt zu überschreiten.
Die Konzentration an Pb2+-Ionen muss dagegen nur 10-8 molar sein, um eine Fällung zu bekommen.
Konsequenz für die analytische Chemie: Über die Sulfide gelingt eine Gruppentrennung!
HgS CuS PbS CdS sind in 1 molarer Säure unlöslich
ZnS CoS NiS FeS MnS sind in 1 molarer Säure löslich
Zum Inhaltsverzeichnis