![]() Zum Inhaltsverzeichnis
Zum Inhaltsverzeichnis
![]() Zurück zum Haupttext
Zurück zum Haupttext
Beim Ethan ist die gestaffelte Konformation die stabile
Rotationsstellung. Dieser einen stabilen Konformation des
Ethans entsprechen beim 1,2-Dichlormethan zwei Energieminima mit
Torsionswinkeln von etwa 60° und exakt 180°. Man spricht von
Konformationsisomeren oder kurz Konformeren. Das sind hier:
- das gauche-1,2-Dichlorethan (Torsionswinkel etwa 60°; gauche, sprich
"goosch") und
- das trans-1,2-Dichlorethan (Torsionswinkel 180°).
Wir zeigen zunächst als Kugel-Stab-Modelle in der Abb. links die
instabile cis-Konformation, in der Mitte das gauche-Rotamer (ein Enantiomer
davon) und rechts das stabile trans-Rotamer.
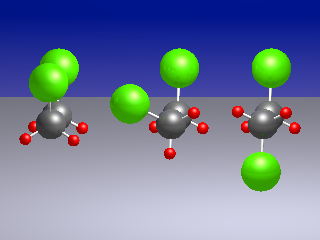
In der cis-Konformation kommen sich die Chlor-Atome sehr nahe. Ferner sind die Bindungsdipolmomente paarweise parallel angeordnet, was zu einer Abstoßung und Destabilisierung führt: Die cis-Konformation ist instabil. Durch eine Torsion der Molekülhäften gegeneinander wird die intramolekulare Abstoßung vermindert. Das gauche-Rotamer entspricht einem Energieminimum. Energetisch noch günstiger ist das trans-Konformer. Im Kristall findet man ausschließlich das trans-Konformer. In der Flüssigkeit und in Lösung sind die Konformeren im thermischen Gleichgewicht miteinander; mit steigender Temperatur nimmt der Anteil an gauche-Konformer zu. In der Schwingungsspektroskopie kann man die spektralen Banden anhand der Temperaturabhängigkeit ihrer relativen Intensitäten den einzelnen Rotameren zuordnen. Das gelang zuerst mit Hilfe der Raman-Spektroskopie (entdeckt 1928) und ab etwa 1950 auch in IR-Spektren.
Wir gehen jetzt noch zu den Newman-Projektionen der Konformeren. In der Abb. sehen Sie links und mittig die beiden zueinander enantiomeren gauche-Konformere und rechts das trans-Konformer.
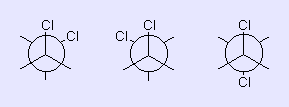
Das trans-Konformer hat die Punktgruppe C2h und ist zentrosymmetrisch. Dagegen haben die gauche-Konformere (wie alle allgemeinen Rotationsstellungen des Moleküls) die reine Drehgruppe C2 und sind deshalb chiral. Eine Trennung der Enantiomeren ist wegen der schnellen internen Rotation und damit auch Enantiomersierung nicht möglich.
Nun gilt es zu verallgemeinern! Beim Butan C4H10 (Methyl-Gruppen statt Chlor-Atome als Kettenende) stehen benachbarte C–H-Bindungen genau wie beim Ethan und Propan auf Lücke. Für die C4-Kette gibt es genau wie beim 1,2-Dichlormethan zwei Möglichkeiten. Im Kristall liegt ausschließlich das stabile trans-Konformer mit Zickzack-Anordnung der vier Kohlenstoff-Atome vor. In Lösung finden sich die enantiomeren gauche-Konformeren im Gleichgewicht vor. Mit Hilfe der 13C{1H}-NMR-Spektroskopie kann man die Rotameren in Lösung bei Temperaturen < -110° C nebeneinander sehen. Beide Rotamere haben zwei Arten von 13C-Kernen: terminale in den Methyl-Gruppen und innere in den Methylen-Gruppen. Man sieht für jedes Rotamer zwei Signale; die relative Intensität der Signale des trans-Rotamers ist umso größer je tiefer die Messtemperatur ist. Ganz allgemein ist bei unverzweigten aliphatischen Kohlenwasserstoff-Ketten die Zickzack-Form am stabilsten.
Neben der trans/gauche-Nomenklatur gibt es eine breiter anwendbare
Nomenklatur von Klyne und Prelog, die
1. enantiomere Konformationen zu unterscheiden vermag und
2. für alle Energieminima und Maxima eigene Bezeichnungen bietet.
Wir listen die Namen zu den Rotationsstellungen auf. Die vom Betrachter aus
hintere Gruppe der Viererkette wird im positiven Sinn, dem Uhrzeigersinn,
gedreht. Es werden also zuerst positive
Diederwinkel und nach 180° negative
Diederwinkel durchlaufen. Die Namen sind:
zu 0°: synperiplanar;
zu 60°: +-synklinal;
zu 120°: +-antiklinal;
zu 180°: antiperiplanar;
zu 240°: --antiklinal;
zu 300°: --synklinal.
Wir verwenden die neuen Vokabeln, indem wir einige Tatsachen wiederholen. Das antiperiplanare Konformer ist das stabile Konformer. Die +-synklinalen und --synklinalen Konformationen entsprechen ebenfalls Energieminima. Die synperiplanare Konformation ist das Maximum der Energie, die +- und --antiklinalen Rotationsstellungen entsprechen Nebenmaxima. Die Energiedifferenz zwischen synperiplanarer (energiereichster) und antiperiplanarer (energieärmster) Konformation ist die Barriere der internen Rotation des Ethan-Derivats. Alles klar!?